Опубликовано
с любезного разрешения профессора В.Л. Быкова.
По В.Л. Быков. Цитология и общая гистология — СПб, СОТИС, 1998
Функция
воспроизведения и передачи генетической информации обеспечивается в ходе клеточного
цикла.
Клеточный цикл - совокупность явлений между двумя последовательными делениями
клетки или между ее образованием и гибелью Клеточный цикл включает собственно
митотическое деление и интерфазу - промежуток между делениями.

Интерфаза
значительно более длительна, чем митоз (обычно занимает не менее 90% всего времени
клеточного цикла) и подразделяется на три периода: пресинтетическип или постмитотический
(G1), синтетический (S) и постсинтетический или премитотический (G2).
1. Пресинтетический или постмитотический (G1) период (от англ.
gap - промежуток) наступает сразу же после митотического деления клетки и характеризуется
активным ростом клетки и синтезом белка и РНК, благодаря чему клетка достигает
нормальных размеров и восстанавливает необходимый набор органелл. G1 -период
длится от нескольких часов до нескольких дней. В течение этого периода синтезируются
особые "запускающие" белки (trigger proteins), или активаторы S-периода.
Они обеспечивают достижение клеткой определенного порога (точки R - рестрикции
или ограничения), после которого она вступает в S-период.
Контроль, осуществляемый на уровне точки R (при переходе из G1 в S), ограничивает
возможность нерегулируемого размножения клеток. Проходя эту точку, клетка переключается
на последующую регуляцию внутренними факторами клеточного цикла, которая обеспечивает
закономерное завершение ее деления.
Если клетка не достигает точки R, она выходит из цикла и вступает в период репродуктивного
покоя (G0) для того, чтобы (в зависимости от причин остановки): (1) дифференцироваться
и выполнять свои специфической функции, (2) выжить в условиях недостаточности
питательных веществ или факторов роста, (3) осуществить репарацию поврежденной
ДНК. Клетки одних тканей при соответствующей стимуляции вновь способны возвращаться
из периода (G0) в клеточный цикл, других - утрачивают эту способность по мере
дифференцировки
2. Синтетический (S-) период характеризуется удвоением содержания
(репликацией) ДНК и синтезом белков, в частности, гистонов, которые поступают
в ядро из цитоплазмы и обеспечивают нуклеосомную упаковку вновь синтезированной
ДНК. В результате происходит удвоение числа хромосом. Одновременно удваивается
число центриолей. S-период длится у большинства клеток 8-12 часов.
3. Постсинтетический или премитотический (G2-)период следует
за S-периодом и продолжается вплоть до митоза (часто обозначаемого буквой М).
В течение этого периода клетка осуществляет непосредственную подготовку к делению.
Происходит созревание центриолей, запасается энергия, синтезируются РНК и белки
(в частности, тубу-лин), необходимые для процесса деления. Длительность G2-периода
составляет 2-4 часа. Возможность выхода клетки из G2-периода в G0-neриод с последующим
возвращением в G2-период в настоящее время большинством авторов отрицается.
Контроль вступления клетки в митоз осуществляется двумя специальными факторами
с противоположно направленными эффектами. Митоз тормозится до момента завершения
репликации ДНК М-задерживающим фактором и индуцируется М-стимулирующим фактором.
Действие последнего проявляется лишь в присутствии других белков - циклинов
(синтезируются на протяжении всего цикла и распадаются в середине митоза).
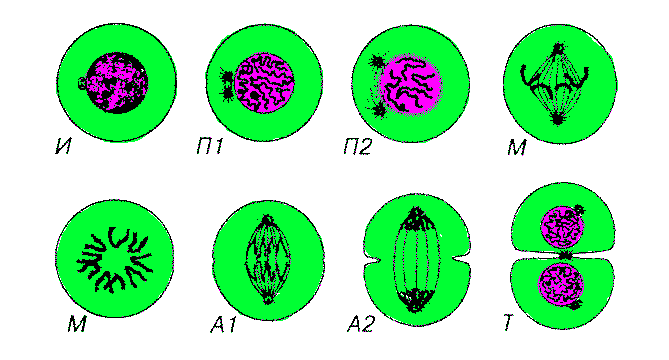
Митоз (от греч. mitos - нить), называемый также кариокинезом, или непрямым делением клеток, является универсальным механизмом деления клеток. Митоз следует за G2-периодом и завершает клеточный цикл. Он длится 1-3 часа и обеспечивает равномерное распределение генетического материала в дочерние клетки. Митоз включает 4 основные фазы профазу, метафазу, анафазу и телофазу.
Профаза начинается с конденсации хромосом, которые становятся видимыми в световой микроскоп как нитевидные структуры. Каждая хромосома состоит из двух параллельно лежащих сестринских хроматид, связанных в области центромеры. Ядрышко и ядерная оболочка к концу фазы исчезают (последняя распадается на мембранные пузырьки, сходные с элементами ЭПС, а поровый комплекс и ламина диссоциируют на субъединицы. Кариоплазма смешивается с цитоплазмой. Центриоли мигрируют к противоположным полюсам клетки и дают начало нитям митотического (ахроматинового) веретена. В области центромеры образуются особые белковые комплексы - кинетохоры, к которым прикрепляются некоторые микротрубочки веретена (кинетохорные микротрубочки); показано, что кинетохоры сами способны индуцировать сборку микротрубочек и поэтому могут служить центрами организации микротрубочек. Остальные микротрубочки веретена называются полюсными, так как они протягиваются от одного полюса клетки к другому; лежащие вне веретена микротрубочки, расходящиеся радиально от клеточных центров к плазмолемме, получили наименование астральных или микротрубочек (нитей) сияния.
Метафаза соответствует максимальному уровню конденсации хромосом, которые выстраиваются в области экватора митотического веретена, образуя картину экваториальной (метафазной) пластинки (вид сбоку) или материнской звезды (вид со стороны полюсов). Хромосомы перемещаются в экваториальную плоскость и удерживаются в ней благодаря сбалансированному натяжению кинетохорных микротрубочек. Сестринские хроматиды к концу этой фазы разделяются щелью, однако удерживаются в области центромеры.
Анафаза начинается с синхронного расщепления всех хромосом на сестринские хроматиды (в области центромеры) и движения дочерних хромосом к противоположным полюсам клетки, которое происходит вдоль микротрубочек веретена со скоростью 0.2-0.5 мкм/мин. Сигнал к началу анафазы включает резкое (на порядок) повышение концентрации Са2+ в гиалоплазме, выделяемого мембранными пузырьками, образующими скопления у полюсов веретена. Механизм движения хромосом в анафазе окончательно не выяснен, однако установлено, что в области веретена помимо актина имеются такие белки как миозин и динеин, а также ряд регуляторных белков и Са2+-АТФаза. По некоторым наблюдениям, оно обусловлено укорочением (разборкой) микротрубочек, прикрепленных к кинетохорам. Анафаза характеризуется удлинением митотического веретена за счет некоторого расхождения полюсов клетки. Она завершается скоплением на полюсах клетки двух идентичных наборов хромосом, которые образуют картины звезд (стадия дочерних звезд). В конце анафазы благодаря сокращению актиновых микрофиламентов, концентрирующихся по окружности клетки (сократимое кольцо), начинает образовываться клеточная перетяжка, которая углубляясь, в следующей фазе приведет к цитотомии.
Телофаза - конечная стадия митоза, в течение которой реконструируются ядра дочерних клеток и завершается их разделение. Вокруг Конденсированных хромосом дочерних клеток из мембранных пузырьков (по другим данным, из аЭПС) восстанавливается кариолемма, с которой связывается формирующаяся ламина, вновь появляются ядрышки, которые образуются из участков соответствующих хромосом. Ядра Клеток постепенно увеличиваются, а хромосомы прогрессивно деспирализуются и исчезают, замещаясь картиной хроматина интерфазного ядpa. Одновременно происходит углубление клеточной перетяжки, и клетки в течение некоторого времени остаются связанными суживающимся цитоплазматическим мостиком, содержащим пучок микротрубочек (срединное тельце). Дальнейшая перешнуровка цитоплазмы завершается формированием двух дочерних клеток. В телофазе происходит распределение органелл между дочерними клетками; равномерности этого процесса способствует то, что одни органеллы достаточно многочисленны (например, митохондрии), другие (подобно ЭПС и комплексу Гольджи) во время митоза распадаются на мелкие фрагменты и пузырьки.
Атипические
митозы возникают при повреждении митотического аппарата и характеризуются
неравномерным распределением генетического материала между клетками - анэуплоидией
(от греч. an - не, eu - правильное, ploon - складываю); во многих случаях цитотомия
отсутствует, в результате чего формируются гигантские клетки. Атипические митозы
характерны для злокачественных опухолей и облученных тканей. Чем выше их частота
и чем значительнее степень анэуплоидии, тем более злокачественной является опухоль.
Нарушение нормального митотического деления клеток может обусловливаться аномалиями
хромосом, которые называют хромосомными аберрациями (от лат. aberratio - отклонение).
Вариантами хромосомных аберраций служат слипание хромосом, их разрыв на фрагменты,
выпадение участка, обмен фрагментами, удвоение отдельных участков хромосом и
др. Хромосомные аберрации могут возникать спонтанно, но чаще развиваются вследствие
действия на клетки мутагенов и ионизирующего облучения.
Кариотипирование - диагностическое исследование с целью оценки кариотипа (набора
хромосом) производится путем изучения хромосом в метафазной пластинке. Для кариотипирования
получают культуру клеток, в которую вводят колхицин - вещество, блокирующее
формирование митотического веретена. Из таких клеток извлекают хромосомы, которые
далее окрашивают и идентифицируют. Нормальный кариотип человека представлен
46 хромосомами - 22 парами аутосом и двумя половыми хромосомами (XY у мужчин
и XX у женщин). Кариотипирование позволяет диагностировать ряд заболеваний,
связанных с хромосомными аномалиями, в частности, синдромы Дауна (трисомия 21-й
хромосомы), Эдвардса (трисомия 18-й хромосомы), Патау (трисомия 13-й хромосомы),
а также ряд синдромов, связанных с аномалиями половых хромосом - синдром Кляйнфельтера
(генотип - XXY), Турнера (генотип - ХО) и др.
Эндомитоз
(от греч. endon -внутри и mitos - нить) - вариант митоза, при котором происходит
удвоение числа хромосом внутри ядерной оболочки без ее разрушения и образования
веретена деления. При повторных эндомитозах число хромосом в ядре может значительно
увеличиваться при соответствующем кратном двум нарастании содержания в нем ДНК
- полиплоидии (от греч. poly - много и ploon - складываю) и увеличении объема
ядра. Полиплоидия может явиться также результатом неоконченных обычных митозов.
Основной смысл развития полиплоидии заключается в усилении функциональной активности
клетки.
Сходный результат достигается при образовании двуядерных клеток вследствие митотического
деления, не сопровождающегося цитотомией. При последующем митотическом делении
такой двуядерной клетки хромосомные наборы ядер объединяются в метафазе, приводя
к образованию двух дочерних полиплоидных клеток. Наличие полиплоидных - тетра-
(4n) и октаплоидных (8n) клеток - нормальное явление в печени, эпителии мочевого
пузыря, клетках концевых отделов поджелудочной и слюнных желез. Мегакариоциты
(гигантские клетки костного мозга) начинают формировать кровяные пластинки лишь
достигнув определенного уровня полиплоидии (16-32n) в результате нескольких
эндомитозов.
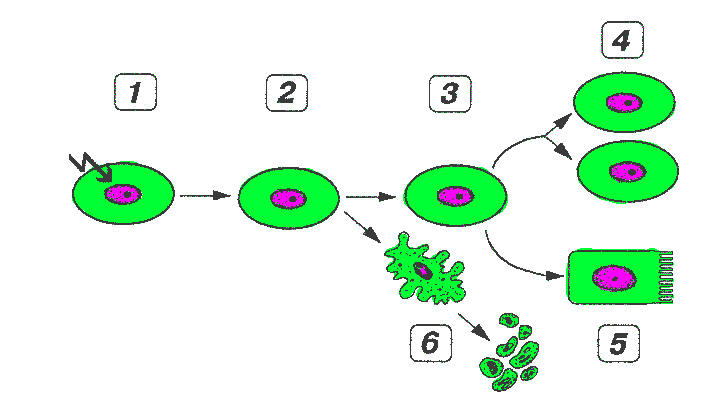
По уровню
обновления клеток все ткани организма подразделяются на три группы.
(1) стабильные клеточные популяции - состоят из клеток с полной
потерей способности к делению (нейроны, кардиомиоциты). Число клеток в такой
популяции стабилизируется в начале их дифференцировки; по мере старения организма
оно снижается вследствие невосполняемой естественной убыли клеток.
(2) растущие клеточные популяции способны не только к обновлению,
но также и к росту, увеличению массы ткани за счет нарастания числа клеток и
их полиплоидизации. Их долгоживущие клетки выполняют специализированные функции,
но сохраняют способность при стимуляции вновь вступать в цикл с тем, чтобы восстановить
свою нормальную численность. Описанные популяции клеток образуют почки, печень,
поджелудочную и щитовидную железы
(3) обновляющиеся клеточные популяции характеризуются постоянным
обновлением клеток; убыль
дифференцированных, выполняющих специализированные функции и неспособных к делению
клеток вследствие их гибели уравновешена образованием новых в результате Деления
малодифференцированных камбиальных клеток и их последующей дифференцировки.
К таким популяциям относят эпителий кишки, эпидермис, а также клетки костного
мозга и крови Регуляция клеточного цикла в различных тканях организма осуществляется
сбалансированной сложной системой механизмов, стимулирующих или ингибирующих
клеточное деление. Система регуляции клеточного цикла получает два вида информации.
(1) о действии на клетку различных внешних факторов, способствующих
активации или торможению ее деления Она обрабатывает и интегрирует ее в виде
сигналов, определяющих, будет ли клетка вступать в митотический цикл или дифференцироваться
и пребывать в периоде репродуктивного покоя (G0).
(2) об интактности генома. При повреждении генома клетки прохождение
ею цикла останавливается и включается система репарации ДНК. Тем самым снижается
вероятность нежелательной репликации поврежденной ДНК. Многочисленные сигналы,
регулирующие деятельность клетки, замыкаются на ген р53, который блокирует прохождение
клеточного цикла до устранения возникшего повреждения. Если это повреждение
слишком серьезно, р53 (в совокупности с другими регуляторами) запускает программу
апоптоза - запрограммированной гибели клетки.
При описании
интерфазы уже были упомянуты внутриклеточные продукты, регулирующие отдельные
этапы подготовки клетки к делению (активаторы S-nepuoдa, М-задерживающий
фактор, М-стимулирующий фактор, циклины). Вместе с тем, имеется ряд
факторов, обеспечивающих общий контроль активности деления клеток, к которым
относятся протоонкогены и антионкогены.
Протоонкогены (от греч. protos - первый и onkos - опухоль) - группа генов-активаторов,
контролирующих нормальное клеточное деление и дифференцировку. Продукты экспрессии
этих генов (особые белки) воздействуют на разные механизмы регуляции деления
клетки: на уровне активирующего сигнала, его рецептора в мембране, второго посредника
или транскрипции. К настоящему времени идентифицировано более 50 протоонкогенов.
Активация функции протоонкогенов и развитие опухолей. Установлено,
что изменения структуры и усиление активности экспрессии протоонкогенов вызывает
развитие опухолей (что определило их название). Повышение активности протоонкогенов
может быть связано с изменениями строения ДНК (в результате мутаций), увеличением
количества генов (генной амплификации) или их реаранжировкой, при которой гены
размещаются вблизи активного промотора. Измененные мутацией, но активные формы
протоонкогенов носят название онкогенов. Злокачественная трансформация клетки
может возникнуть не только вследствие повышения активности протоонкогенов, но
и в результате снижения активности другой группы генов, называемых антионкогенами
Антионкогены - гены, продукты которых - супрессоры опухолевого роста - угнетают
митотическую активность клеток. Из них наиболее подробно изучены гены RB
(ретинобластомы), DCC, APC, WT1,
NF1 и, особенно, ген р53.
Ген р53 - один из наиболее мощных и универсальных антионкогенов (естественный
онкосупрессор) - обеспечивает поддержание стабильности генетического аппарата
(благодаря чему его называют "охранителем" клеточного генома) и контролирует
клеточный цикл. Его экспрессия, умеренная в нормальных условиях, резко усиливается
при повреждении ДНК.
Активация гена р53 приводит к остановке клеточного цикла для Репарации ДНК,
в которой активное участие принимает продукт этого гена - белок р53 - благодаря
способности связываться с поврежденным участком ДНК и регулировать восстановление
его структуры. При тяжелых повреждениях, не устранимых путем репарации ДНК,
р53 запускает программу апоптоза. Оба вида реакций защищают организм от репликации
и амплификации генетически поврежденного материала. Продукт гена р53 (белок
р53) индуцирует синтез продуктов генов р21, р15 и р16, которые блокируют ферменты
циклинзависимые киназы (CDK), обеспечивающие переход G1®S и прохождение других
периодов клеточного цикла.
Инактивация функции антионкогенов и развитие опухолей. Потеря
функции гена р53 (в результате мутации или делеции) приводит к утрате контроля
над клеточным циклом: клетки-мутанты продолжают активно пролиферировать, несмотря
на повреждения ДНК. Выявлена четкая связь между утратой функции гена р53 и развитием
более 50 видов злокачественных опухолей у человека. Так, изменения гена р53
обнаружены в 55-70% случаев рака легкого, в 25-30% - рака молочной железы. Опухоли
с потерей функции гена р53 характеризуются наиболее злокачественным течением.
В некоторых видах опухолей (в 60% меланом и лейкозов, в 80% глиом) обнаруживаются
изменения гена р16; описаны опухоли, связанные с дефектами гена р15. Клетки
рака шейки матки часто содержат инактивировашгые гены RB и р53. Мутация гена
RB обнаруживается при ретинобластоме, опухолях костей, мочевого пузыря, легкого
и молочной железы. Деления гена DCC характерна для опухолей толстой и прямой
кишки, АРС - для аденоматозного полипоза толстой кишки.
Факторы роста являются важными стимуляторами клеточного деления. Они представляют собой белки, усиливающие митотическую активность в определенных тканях (тканях-мишенях). Их действие опосредуется специфическими рецепторами на плазмолемме клеток. К ним относятся фактор роста нервов (ФРН), эпидермалъный фактор роста, (ЭФР), тромбоцитарный фактор роста (ТРФР), инсулиноподобные факторы роста (ИФР), фактор роста фибробластов (ФРФ), колониестимулирующие факторы (КСФ) - стимуляторы отдельных этапов гематопоэза, интерлейкины (ИЛ) -1, -2 и -3. Список факторов роста постоянно расширяется. Высказывается предположение, что большинство типов клеток реагирует не на один специфический фактор роста, а на их комбинации. Некоторые факторы роста циркулируют в крови, но большинство действует в тканях локально (паракринно). Описаны также факторы, подавляющие клеточное деление.
Кейлоны
(от греч. chalao - успокаивать) представляют собой класс гормоноподобных регуляторов,
угнетающих клеточное размножение. Они являются полипептидами или гликопротеинами
и обладают тканевой и клеточной специфичностью. Кейлоны образуются всеми зрелыми
дифференцированными клетками и локально воздействуют на незрелые клетки этой
же ткани, способные к делению. Они обеспечивают гомео-стаз численности клеточной
популяции, а их выделение контролируется механизмом отрицательной обратной связи.
Уменьшение численности популяции клеток (например, потеря клеток эпидермиса
при ранении или лейкоцитов при кровотечении) вызывает снижение ингибирующего
воздествия кейлонов и подъем митотической активности в соответствующей ткани.
Кейлоны участвуют в регуляции роста тканей, заживления ран, иммунных реакций
и других процессах.
Блокирование клеточного цикла с целью задержки размножения быстро растущих раковых
клеток лежит в основе действия ряда препаратов, используемых для лечения опухолей.
К сожалению, эти препараты действуют также на нормальные клетки и оказывают
на них вредное влияние - побочное действие препарата. Последнее особенно выражено
в отношении быстро обновляющихся популяций, так как значительная часть их клеток
находится в цикле. В наибольшей степени при введении противоопухолевых препаратов
нарушается образование форменных элементов крови (с развитием анемии), а также
клеток кишечного эпителия (с возможным возникновением его изъязвлений).